Pengertian & Penjelasan Konsep Mol.
Unit jumlah zat dalam pengetahuan kimia dimaksud dengan mol. Satu mol zat memiliki kandungan partikel yang jumlahnya sama juga dengan jumlah partikel dalam 12 gr C–12, yakni 6, 02 × 1023 partikel.
Jumlah partikel ini dikatakan sebagai bilangan Avogadro. Partikel zat bisa berbentuk atom, molekul, atau juga ion seperti diterangkan dengan contoh-contoh dibawah.
Cermati Contoh-contoh tersebut :
• 1 mol besi (Fe) memiliki kandungan 6, 02 × 1023 atom besi (dalam soal ini partikel unsur besi yaitu atom). Lalu jumlah partikel besi yaitu sama juga dengan jumlah atom besi.
• 1 mol air (H2O) memiliki kandungan 6, 02 × 1023 molekul air (dalam soal ini partikel senyawa air yaitu molekul). Lalu jumlah partikel air yaitu sama juga dengan jumlah molekul air.
• 1 mol Na+ memiliki kandungan 6, 02 × 1023 ion Na+ (dalam soal ini partikel ion Na+ yaitu ion). Lalu jumlah partikel Na+ yaitu sama juga dengan jumlah ion Na+.
• 5 mol CO2 memiliki kandungan 5 × 6, 02 × 1023 = 3, 01 × 1024 molekul CO2.
• 0, 2 mol hidrogen memiliki kandungan 0, 2 × 6, 02 × 1023 = 1, 204 × 1023 atom hidrogen.
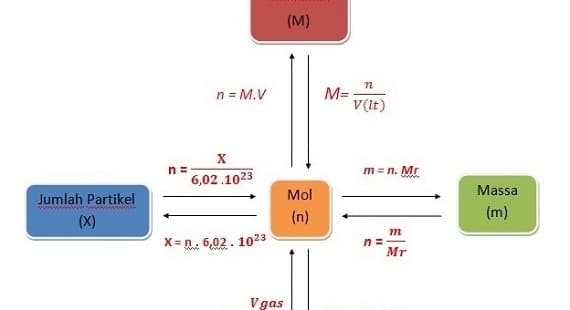
Mengkalkulasi Jumlah Partikel Satu Zat.
Jalinan pada jumlah partikel dalam zat dengan jumlah mol bisa dinyatakan dengan formula seperti berikut :
X = n x L
X = jumlah partikel
n = mol
L = tetapan Avogadro = x 6, 02 × 1023 partikel/mol
Contoh :
Total partikel (atom emas) yang dipunyai oleh 5 mol emas murni yaitu :
X = n × 6, 02 × 1023 partikel/mol
X = 5 mol × 6, 02 × 1023 partikel/mol
X = 3, 01 × 1024 atom emas
Lalu dalam 5 mol emas ada 3, 01 x 1024 atom emas.
Mengkalkulasi Jumlah Massa Molar Satu Zat.
Massa molar menyebutkan massa yang dipunyai oleh 1 mol zat. Massa molar biasanya dinotasikan dengan mm.
Massa 1 mol zat sama juga dengan massa molekul relatif zat itu dengan satuannya dinyatakan oleh gr/mol. Massa molekul relatif umumnya dinyatakan dengan Mr.
Untuk unsur yang partikelnya berbentuk atom, jadi massa molar yaitu sama juga dengan massa atom relatifnya dalam unit gr/mol. Massa atom relatif umum dinotasikan dengan Ar
Cermati Contoh-contoh tersebut :
• Massa molar kalsium (Ca) = massa dari 1 mol kalsium (Ca) = massa relatif atom (Ar) Ca = 40 gr/mol.
• Massa molar besi (Fe) = massa dari 1 mol besi (Fe) = massa relatif atom (Ar) Fe = 56 gr/mol.
• Massa molar aluminium (Al) = massa dari 1 mol aluminium (Al) = = massa relatif atom (Ar) Al = 27 gr/mol.
Dengan hal tersebut di ketahui kalau :
Massa molar Ca = 40 gr/mol
Massa molar Fe = 56 gr/mol
Massa molar Al = 27 gr/mol
Mengkalkulasi Jumlah Mol Satu Zat
Satu mol didefinisikan sebagai jumlah zat yang memiliki kandungan partikel zat itu sejumlah atom yang ada dalam 12, 000 g atom karbon –12.
Sedang Massa satu mol zat diberi nama massa molar (dinotasikan sebagai Mr). Besarnya massa molar zat yaitu massa atom relatif atau juga massa molekul relatif zat yang dinyatakan dalam unit gr per mol.
Jumlah mol yang terdapat dalam satu zat bisa diformulasikan seperti berikut :
n = M/Ar atau juga n = M/Mr
n = mol
M = massa zat atau juga massa molekul (gr)
Ar = massa atom relatif
Mr = massa molekul relatif
Contoh Perhitungan Mol :
Jumlah mol untuk besi sejumlah 560 gr yaitu :
M = 560 gram
Ar Fe = 56
Lantaran massa atom relatif besi bisa dinyatakan dengan massa molar besi, jadi unit massa atom relatif besi bisa dinyatakan dengan gr/mol. Lalu jumlah mol dalam 560 gr zat besi yaitu :
n = 560 gr/56 gr/mol
n = 10 mol
Contoh Perhitungan Mol.
Mengitung jumlah mol dalam 180 gr air yaitu :
Mr = massa molekul relatif air yaitu :
Mr H2O = (2 x Ar H) + (1 x Ar O)
Mr H2O = (2 x 1) + (1 x 16)
Mr H2O = 18
Dengan hal tersebut, jumlah mol dalam 180 gr air yaitu :
n = 180 gr/18 gr/mol = 10 mol.